要点
- タンパク質の働きを制御するユビキチン鎖の働きを止める脱ユビキチン化酵素USP25の基質特異性を解明
- USP25のユビキチン鎖結合領域を改変することで、そのユビキチン鎖切断の特異性を改変することに成功
- 脱ユビキチン化酵素によるタンパク質機能制御の仕組みについて理解が深まる
概要
東京工業大学 科学技術創成研究院 細胞制御工学研究ユニットの川口紘平大学院生(博士後期課程)と駒田雅之教授らは、ヒト細胞の機能を制御する酵素タンパク質「USP25」が特定の基質のみに働く仕組み(基質特異性)の獲得機構を解明、その基質特異性を改変することに成功した。
ユビキチン[用語1]は、自身のリジン残基[用語2]を介してつながりユビキチン鎖[用語3]を形成、細胞内の様々な標的タンパク質と結合し、それらの機能を制御する。この時、ユビキチン鎖がユビキチンの48番目のリジン(Lys48)と63番目のリジン(Lys63)のどちらを介して連結するかで、標的となるタンパク質は異なる制御を受ける。一方、このユビキチン化によるタンパク質制御は、脱ユビキチン化酵素[用語4]が標的タンパク質に結合したユビキチン鎖を切断することで解除される。
今回の研究では、脱ユビキチン化酵素の1つ「USP25」が、ユビキチンと結合するための配列であるUIMを介してLys48連結ユビキチン鎖に選択的に結合することで、Lys48連結ユビキチン鎖を選択的に切断することを解明した。また、このUIMをLys63連結ユビキチン鎖に結合できるように改変したところ、Lys63連結ユビキチン鎖を切断することに成功した。つまりUSP25の基質特異性を改変させることができた。
今回の成果は、ユビキチン化による複雑なタンパク質制御機構の一端を解明するもので、ヒト細胞の制御機構の分子基盤の理解に結びつく重要な生物学上の知見と言える。
3月22日付けの国際科学誌『Scientific Reports』にオンライン掲載された。
背景
ユビキチンは真核生物に高度に保存された、76アミノ酸からなる小さなタンパク質である。細胞内では、ユビキチンのカルボキシル末端と別のユビキチンのリジン残基のε-アミノ基がアミド結合でつながることで、複数のユビキチンが数珠状につながったユビキチン鎖(ユビキチン多量体)が作られる。この時、ユビキチンのどのリジン残基を介してユビキチン鎖がつながるかで、異なった立体構造をもつユビキチン鎖が形成される。細胞内にはユビキチンの48番目のリジン残基(Lys48)あるいは63番目のリジン残基(Lys63)を介して形成したユビキチン鎖が豊富に存在する(図1)。
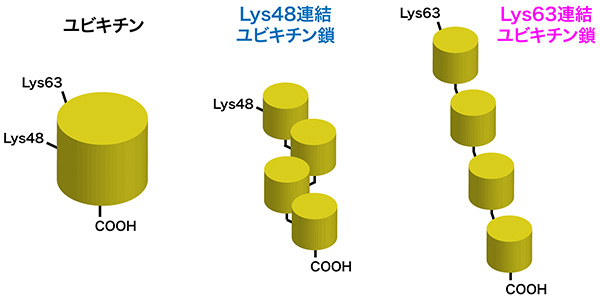
図1. ユビキチンとユビキチン鎖
ユビキチンのカルボキシル末端のカルボキシル基(COOH)と、別のユビキチンのリジン残基(主にLys48とLys63)がアミド結合でつながることで、ユビキチン鎖が形成される。Lys48連結ユビキチン鎖とLys63連結ユビキチン鎖は異なる立体構造をもつ。
ユビキチン鎖は、その末端カルボキシル基を介して様々な細胞内タンパク質のリジン残基に付加されることで、それら標的タンパク質の機能を制御する(図2)。異なるタイプのユビキチン鎖は、異なる働きをもつ。Lys48連結ユビキチン鎖はそのタンパク質を分解する目印となるのに対し、Lys63連結ユビキチン鎖は損傷DNAの修復や細胞内の情報伝達など、様々な細胞機能を調節する。
一方、細胞内には何十種類もの脱ユビキチン化酵素が存在し、標的タンパク質に結合したユビキチン鎖を加水分解して切断することで、ユビキチン化によるタンパク質制御を解除する(図2)。Lys48連結ユビキチン鎖とLys63連結ユビキチン鎖の機能が異なるため、脱ユビキチン化酵素がユビキチン化によるタンパク質制御を緻密にコントロールするには、Lys48連結ユビキチン鎖とLys63連結ユビキチン鎖のいずれかを選択的に切断する必要があるはずである。しかし、脱ユビキチン化酵素がどのようにして特定のユビキチン鎖を選択的に切断するのか、その基質特異性の獲得機構はよくわかっていなかった。
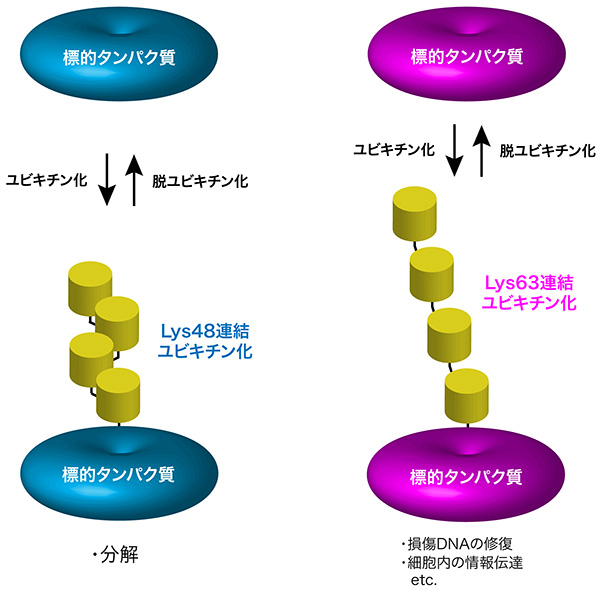
図2. タンパク質のユビキチン化とそのはたらき
ユビキチン鎖は、その末端のカルボキシル基を介して様々な細胞内タンパク質のリジン残基に付加される(ユビキチン化)。Lys48連結ユビキチン鎖の付加はそのタンパク質を分解する目印となるのに対し、Lys63連結ユビキチン鎖の付加は様々な細胞機能を制御する。また、ユビキチン化によるタンパク質制御は、脱ユビキチン化酵素によるユビキチン鎖の切断(脱ユビキチン化)により解除される。
研究成果
川口大学院生と駒田教授らは、ヒトの脱ユビキチン化酵素の1つであるUSP25を培養細胞に過剰発現させて精製し、試験管内でLys48連結またはLys63連結のユビキチン鎖と反応させて、ユビキチン鎖の切断活性(脱ユビキチン化活性)を調べた。その結果、USP25はLys48連結ユビキチン鎖をLys63連結鎖より効率よく切断することがわかった。
USP25は酵素活性ドメインに加え、約20アミノ酸からなるユビキチン結合能をもつ配列UIM(ubiquitin-interacting motif、ユビキチン結合モチーフ)を2つ連続してもっている。これら2つのUIMの両方にユビキチンと結合できなくなる変異を導入したところ、Lys48連結とLys63連結のいずれのユビキチン鎖に対してもUSP25の切断活性が低下した。このことから、2つの連続UIMを介したユビキチン鎖(基質)との結合がUSP25のユビキチン鎖切断活性を高めていることが明らかとなった。
この連続したUIMのLys48連結ユビキチン鎖とLys63連結ユビキチン鎖に対する結合親和性を比較したところ、Lys63連結鎖よりLys48連結鎖に強く結合することがわかった。つまり、連続UIMのLys48連結ユビキチン鎖に対する結合特異性がUSP25のLys48連結ユビキチン鎖に対する切断特異性を規定していることが示唆された。
そこで、USP25の連続UIMのユビキチン鎖結合特異性をLys48連結鎖からLys63連結鎖に改変することで、USP25のユビキチン鎖切断特異性をLys63連結鎖に改変できるのではないかと考えた。この仮説を検証するため、USP25の連続UIMを、Lys63連結ユビキチン鎖に対して結合特異性をもつ他のタンパク質の連続UIMで置換し、その変異体のユビキチン鎖切断特異性を調べたところ、このUSP25変異体ではLys48連結鎖に対する切断活性が低下し、Lys63連結鎖切断活性が上昇した。
以上の結果から、USP25は2つの連なったUIMを介してLys48連結ユビキチン鎖を選択的に酵素活性中心の近傍につなぎ留めることで、Lys48連結ユビキチン鎖に対して高い切断活性を発揮することが解明された(図3)。
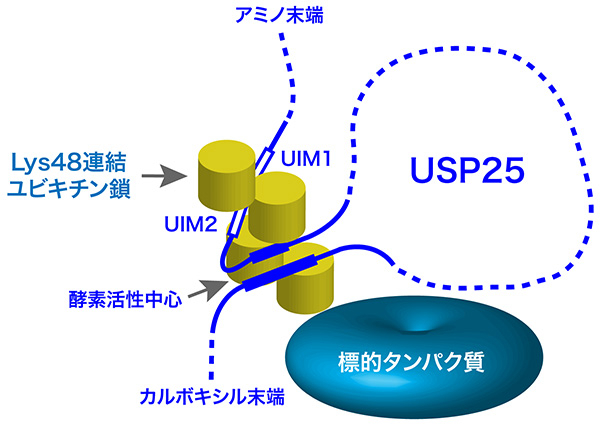
図3. USP25の基質特異性の獲得機構(モデル)
USP25は連続した2つのユビキチン結合配列(UIM1とUIM2)を介してLys48連結ユビキチン鎖を選択的に酵素活性中心の近傍につなぎ留めることにより、Lys48連結ユビキチン鎖に選択的な切断活性を発揮する。
研究成果の意義
タンパク質のユビキチン化は、ユビキチン鎖の連結パターンの違いによって標的タンパク質への作用が異なるため、それぞれの標的タンパク質にどの連結型のユビキチン鎖をつけるのか、またどの連結型のユビキチン鎖を解除するのかが、細胞のおかれた状況に応じてそのタンパク質の働きを緻密に制御する上で重要となる。この成果は、ユビキチン化による複雑なタンパク質制御を可能にするメカニズムの一端を解明したもので、私たちヒトの細胞機能の制御機構のより深い理解に結びつくことが期待される。
用語説明
[用語1] ユビキチン : 真核生物において高度に保存された、76アミノ酸からなる小さな細胞内タンパク質。
[用語2] リジン残基 : タンパク質を構成する20種類のアミノ酸のうちの1つであり、Lysと略される。側鎖の末端にアミノ基(ε-アミノ基)をもつ。ユビキチンを構成する76アミノ酸のうち、7つがリジン残基である。
[用語3] ユビキチン鎖 : ユビキチンのカルボキシル末端のカルボキシル基と別のユビキチンのリジン残基のε-アミノ基がアミド結合でつながることにより、複数のユビキチンが数珠状につながったユビキチン多量体が細胞内で作られる。これをユビキチン鎖という。ユビキチン鎖は、その末端のユビキチンのカルボキシル末端を介して様々な細胞内タンパク質のリジン残基のε-アミノ基にアミド結合で付加され、それら標的タンパク質の機能を様々に制御する。このタンパク質修飾をユビキチン化という。
[用語4] 脱ユビキチン化酵素 : ユビキチン鎖のユビキチンとユビキチンの間、およびユビキチンと標的タンパク質の間のアミド結合を加水分解し、標的タンパク質からユビキチン鎖をはずす酵素。ヒトには約90種類存在し、それぞれが異なる標的タンパク質を脱ユビキチン化する。
論文情報
掲載誌 : |
Sci. Rep., 7, 45037 (2017) |
論文タイトル : |
Tandem UIMs confer Lys48 ubiquitin chain substrate preference to deubiquitinase USP25 |
著者 : |
Kohei Kawaguchi, Kazune Uo, Toshiaki Tanaka & Masayuki Komada |
DOI : |
お問い合わせ先
東京工業大学 科学技術創成研究院
細胞制御工学研究ユニット
教授 駒田雅之
E-mail : makomada@bio.titech.ac.jp
Tel : 045-924-5703 / Fax : 045-924-5771
取材申し込み先
東京工業大学 広報センター
E-mail : media@jim.titech.ac.jp
Tel : 03-5734-2975 / Fax : 03-5734-3661

