概要
中央大学 理工学部の鈴木宏明教授、理工学研究科の牛山涼太大学院生(研究当時)と南條哲至、津金麻実子共同研究員、佐藤玲子技術補佐員および東京工業大学 地球生命研究所(ELSI)の松浦友亮教授の研究グループは、マイクロ流体工学を基に、大きさが均一かつ均質な人工細胞[用語1]を製造する技術を開発しました。
タンパク質やDNAなどの生体高分子と、細胞膜を構成する脂質などの分子をボトムアップに組み合わせて、人工細胞(artificial cell)を創るという試みは、理学的な基礎研究としてだけではなく、次世代のバイオテクノロジーの創成に向けて注目されています。しかし、細胞膜となる脂質二重膜小胞(リポソーム)[用語2]を均一かつ均質に作ることが困難でした。
本研究グループは、2021年に、製造と操作が非常に簡単な、人工細胞製造用マイクロ流路チップの開発を国際論文で報告しています[参考文献1]。この技術を応用し、本研究では、人工細胞としてのリポソーム中に市販の無細胞タンパク質合成系を封入して目的のタンパク質を合成するために、求められる成分や条件を特定しました。最終的には、直径10~50マイクロメートル程度のリポソーム中で、水溶性のモデルタンパク質としての緑色蛍光タンパク質(GFP)と膜タンパク質のモデルとしてのα-ヘモリシン(膜にナノポアを形成するペプチド)が合成できることを確認しました。
この技術により、内部でタンパク質を合成する均一・均質な人工細胞製造の標準化が可能となり、バイオ医薬品や膜タンパク質バイオセンサーの産業利用につながることが期待されます。使用したタンパク質合成システム(PURE frex®1.0)は、日本の企業(ジーンフロンティア株式会社)により製造・販売されているものであり、オールジャパンの人工細胞製造プラットフォームとしての展開も期待されます。
本研究成果は、2023年11月30日(米国東部時間)付で、合成生物学に関連した国際学術誌 「ACS Synthetic Biology」でオンライン掲載されました。

(上)均一人工細胞製造用マイクロ流体チップの外観。(下)この流路で製造し回収した均一な人工細胞容器(巨大リポソーム)
研究者代表
鈴木宏明 中央大学 理工学部 精密機械工学科 教授
松浦友亮 東京工業大学 地球生命研究所(ELSI)教授
背景
人工細胞は、細胞の階層構造や密集状態を模倣した細胞サイズのバイオリアクターであり、細胞の特性を再現したり定量的に調べるためのツールとして利用されています。また、有用物質の生物生産やバイオセンシングへの応用も検討されています。人工細胞技術を産業応用に利用するには、均一・均質化は重要です。すなわち、簡便で再現性よく、生体分子のカプセル化効率が高く、均一・均質な巨大脂質二重膜小胞(リポソーム)の製造法の確立が重要です。従来の方法では、直径が0.1~数十ミクロンと非常にサイズのばらつきが大きいリポソームしかできませんでした。近年、マイクロ流路等を用いた均一・均質な人工細胞製造法が発表されていましたが(N-N. Deng et al., JACS, 2016; S. Deshpande et al., Nature Communications, 2016)、再現性や操作性の面で課題がありました。
研究成果
均一な人工細胞の容器としてのリポソームは、はじめに脂質を含むオイル中で均一な水滴(water-in-oilエマルション)をマイクロ流路内で作製し、それを外側からさらに水相で包み込むことで、脂質で安定化されたオイルの殻(ダブルエマルション、Water-in-oil-in-waterエマルションとも呼ばれる)を作製します。最終的に、このオイルの殻を薄膜にすることで、脂質二重膜小胞であるリポソームとなります。ここで、オイル中の水滴ができる流路の部分は疎水性、ダブルエマルションができる流路の部分は親水性である必要があり、流路製造上の課題となっていました(図1a)。また、薄いオイルの殻を作るためには、流体の流量制御がシビアで、再現性にも難がありました。本研究グループが2021年に発表した論文では、特にオイル相の流路内壁に対する濡れ性を詳しく検討し、親・疎水性の処理をすることなく、かつ、流量の制御が簡便で再現性の高いマイクロ流路を用いた人工細胞製造法を発表していました(図1b)。
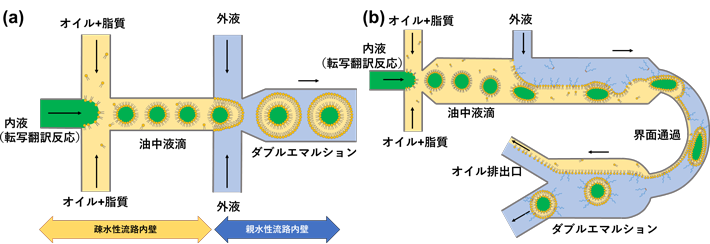
- 図1.
- マイクロ流路中で行われる、均一な巨大リポソームの形成過程の模式図。(a)従来のマイクロ流路では、流路の内壁を疎水性と親水性に塗り分ける必要があり、製造工程が困難。(b)本研究グループが開発した方法は、疎水・親水性の塗り分けが不要で、かつ油中水滴の界面通過を利用することで大雑把な流量調整でも再現性良く人工細胞容器としての巨大リポソームができる。
細胞内で行われる根源的な反応のひとつに、DNAからmRNA、そしてタンパク質ができる転写・翻訳反応があります。大腸菌の転写・翻訳反応に最低限必要な核酸、タンパク質等の成分を人工的に組み合わせた再構成型無細胞タンパク質合成系PURE system(製品名はPURE frex®、ジーンフロンティア株式会社が製造・販売)は、細胞を用いることなく試験管内でタンパク質を合成できるシステムです。PURE systemはこれまで人工細胞内で転写・翻訳反応を行うのに世界中で広く用いられてきました。しかし、このシステムは塩濃度が高く、疎水的な分子も含まれているため、マイクロ流路でのリポソーム形成過程が不安定になるという問題がありました。研究グループは、膜を構成する脂質分子や外液となる溶液組成を入念に検討し、PURE systemを安定して人工細胞容器に封入できる条件を特定しました。
加えて、マイクロ流路を用いて均一な人工細胞容器に封入し、その中でタンパク質合成を行うことに成功しました。モデルタンパク質として、緑色蛍光タンパク質(GFP)(図2)とα-ヘモリシンが合成できることを確認しました(図3)。特に、α-ヘモリシンは、合成後に膜に移行して物質透過を促すナノポアを形成するモデル膜タンパク質として使われるものです。従って、今回の研究成果によって、マイクロ流路で形成した均一リポソームの膜が、細胞のセンサーや物質輸送に使われる膜タンパク質の足場として利用できることが明らかになりました。
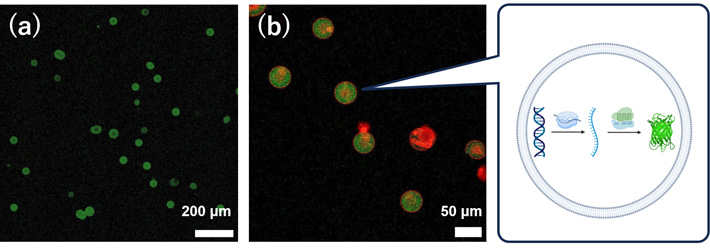
- 図2.
- 流路から回収した均一・均質な巨大リポソームと、その内部でGFPが合成された様子(緑色蛍光として光る)。(a) 低倍率での観察。(b) 高倍率での観察。赤は脂質膜。右はリポソーム内で転写翻訳反応によりGFPができる模式図。
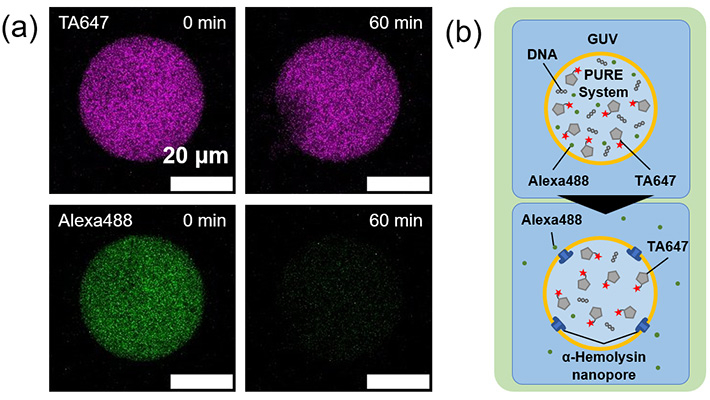
- 図3.
- (a) α-ヘモリシンの合成により、膜上にナノポアが再構成され、マーカー蛍光分子が漏出して蛍光輝度が減少する様子。マゼンダ色の蛍光付加タンパク質(Transferrin labeled with AlexaFluor647 (TA647)、分子量約60,000)はナノポアよりも大きいため、60分後にも漏出しないが、小さい蛍光マーカーであるAlexaFluor488(緑色、分子量732)は漏出する。このことから、転写翻訳反応により合成されたα-ヘモリシンが膜上でナノポアを形成したことが確認できる。(b) ナノポア形成と漏出の模式図。
今後の展開
今後は、より高次の機能を有する膜タンパク質の合成と膜への再構成を進め、バイオセンサー応用へのテストを重ねるとともに、タンパク質合成以外の反応系(ゲノム増幅や複製など)もテストし、汎用的な人工細胞製造技術として磨き上げたいと考えています。
付記
-
科学研究費補助金(文部科学省)
主な研究経費:基盤研究(B)(鈴木宏明代表、19H02576)「脂質二重膜バイオリアクタ形成デバイスの開発とバイオマーカ検出技術への応用」、学術変革領域(A)(瀧ノ上正浩代表、20H05935)「DNAナノスケールのモダリティ」
部分的な研究経費:基盤研究(A)(川野竜司代表、19H00901)「分子演算システムによる腫瘍由来核酸の高速パターン診断」、学術変革領域研究(A)公募研究(津金麻実子代表、21H05890)「マイクロ流体デバイスと自己組織化による人工多細胞体モデルの構築」、基盤研究(C)(津金麻実子代表、21K04851)「エクソソーム内封マイクロRNA解析マイクロデバイスの開発」、国際共同研究加速基金(国際先導研究)(廣瀬敬代表、22K21344)「太陽系に広がる惑星環境における前生命化学進化と分子システム誕生の多様性の解明」、学術変革領域研究(A) (松浦友亮代表、21H05228)「天然で起こりえない進化を実現する無細胞分子システムのボトムアップ構築」 -
科学研究費補助金以外の研究経費
ヒューマン・フロンティア・サイエンス・プログラム(松浦友亮代表、RGP003/2023)
「Autonomous evolution of synthetic cells under non-equilibrium conditions」
参考文献
[1] 人工細胞製造用マイクロ流路チップ(既発表)
R. Ushiyama, K. Koiwai, H. Suzuki, "Plug-and-Play Microfluidic Production of Monodisperse Giant Unilamellar Vesicles Using Droplet Transfer across Water-Oil Interface", Sensors and Actuators B: Chemical, 355, 131281, 2021.
DOI : 10.1016/j.snb.2021.131281
用語説明
[用語1] 人工細胞 : 既存の細胞に遺伝子組み換えなどの改変を加えるのではなく、タンパク質やDNA、エネルギー分子、膜を構成する分子、その他のさまざまな分子などを組み合わせて創られる、細胞の特徴を模擬した分子集合体。目的によってさまざまな分子の組み合わせのパターンがあるが、多くの場合、脂質二重膜小胞や油中液滴(ドロップレット)など、細胞に近いサイズの微小区画にDNAや細胞質成分となる分子を封入して作られる。
[用語2] 脂質二重膜小胞(リポソーム) : 細胞膜の主要構成成分である、リン脂質の二重膜でできた袋。細胞とその外界を分け隔て、かつ、選択的な物質の流入出を制御したり、信号を受容したりする膜タンパク質の足場となる。同種の細胞はサイズがおよそ均一だが、従来のリポソーム作製法では、基本的にサイズがばらばらのものしかできない。また、人工細胞を構築する上で、生体高分子を高密度で封入できることが重要。マイクロ流路を用いた製造法では、この2つの要件を満たすことができるが、これまでに汎用的な方法は普及していない。
論文情報
掲載誌 : |
ACS Synthetic Biology |
論文タイトル : |
Identifying Conditions for Protein Synthesis Inside Giant Vesicles Using Microfluidics toward Standardized Artificial Cell Production |
著者 : |
Ryota Ushiyama, Satoshi Nanjo, Mamiko Tsugane, Reiko Sato, Tomoaki Matsuura, and Hiroaki Suzuki |
DOI : |
- プレスリリース 均一かつ均質な人工細胞を作るマイクロ流路システムを開発 —細胞サイズの脂質膜小胞中でタンパク質合成を行う人工細胞製造法の標準化に前進—
- 松浦友亮 Tomoaki Matsuura|研究者検索システム 東京工業大学STARサーチ
- 松浦研究室
- 【研究室紹介】松浦研究室|生命理工学系 News
- 生命理工学系を担当する松浦友亮教授と藤島皓介准教授がそれぞれ2023年度HFSPグラントを受賞しました|生命理工学系 News
- 生命理工学院 生命理工学系
- 地球生命研究所(ELSI)
- 国際先駆研究機構
- 研究成果一覧
お問い合わせ先
東京工業大学 国際先駆研究機構 地球生命研究所
教授 松浦友亮
Email matsuura_tomoaki@elsi.jp
中央大学 理工学部 精密機械工学科
教授 鈴木宏明
Email suzuki@mech.chuo-u.ac.jp
Tel 03-3817-1827
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661
中央大学 研究支援室
Email kkouhou-grp@g.chuo-u.ac.jp
Tel 03-3817-7423 / Fax 03-3817-1677