要点
- 蛍光[用語1]タンパク質[用語2]同士の距離によって蛍光波長が変化する現象を利用した、引張りを感知できるタンパク質センサの応答を改良した。
- このセンサの遺伝子を組み込み、からだ中の組織、細胞が引張りに応じて色が変わるような遺伝子改変マウスを作製した。
- これまで作製された同様のマウスの観察には高額な顕微鏡が必要だったが、今回のマウスは一般の研究室に普及する「共焦点顕微鏡[用語3]」で観察することが可能である。
- 生体内の細胞レベルの力分布計測[用語4]のツールとして、メカノバイオロジー分野への大きな貢献が期待できる。
概要
東京工業大学 科学技術創成研究院 化学生命科学研究所の北口哲也准教授は、国立大学法人東海国立大学機構 名古屋大学大学院工学研究科の松本健郎教授、王軍鋒研究員、前田英次郎准教授らの研究グループと理化学研究所 光量子工学研究センターの横田秀夫チームリーダーらと共同で、体中の組織の蛍光色が引張りに応じて変化するマウスの系統を新たに作製しました。
筋肉を鍛えると太く逞しくなるように、生物の組織、細胞、タンパク質は外界からの力から大きな影響を受けます。このような、力が生物に及ぼす影響を調べる分野をメカノバイオロジーと呼びますが、その発展には細胞やタンパク質に加わる力を安定的に可視化する方法が非常に重要です。そのために、従来「FRET型張力センサ」と呼ばれる、引張りによって蛍光色が変化するタンパク質を利用する方法が用いられてきました。しかし、このセンサの遺伝子を組み込んだマウスは、応答が十分でないために、観察には1億円近くする高価な顕微鏡(FILM[用語5])で精密に測定する必要がありました。
今回私たちは「FRET型張力センサ」の応答を改良し、その遺伝子を持つ遺伝子改変マウスの作出に成功しました。このマウスでは研究現場に広く普及している「共焦点顕微鏡」で張力変化を観察できることを、血管、腱、筋肉、それらから単離した細胞で確認しました。また、組織や細胞によって張力に対する感度が違うことを発見し、その原因は組織や細胞の微細構造の差や、組織ごとの機能の差によって生じる可能性があると結論づけました。
本研究で開発したマウスを使うことで、様々な組織や細胞内の張力変化に加え、発生、成長、老化の過程における応答の変化も簡便に調べられるため、幅広いメカノバイオロジー分野への貢献が期待されます。
本研究成果は、2023年12月20日付英科学雑誌『Scientific Reports』に掲載されました。
Image may be NSFW.
Clik here to view.
研究背景と内容
鍛えると私たちの筋肉が太く逞しくなることからも判るように、私たちの体の状態は外界から作用する力と密接な関係があります。この力は組織のような大きなレベルだけでなく、組織内部の細胞、更には細胞内部のタンパク質に対しても、その機能の発現や形態に大きな影響を与えることが明らかとなってきています。このような、力の生物に対する影響を調べる分野をメカノバイオロジーと呼びますが、組織内部の細胞に加わる力やタンパク質に加わる力を安定的に可視化する方法が非常に重要となります。
ところで、多くの細胞内部には「ストレス・ファイバー(SF)」という線維が走っています(図1上)。SFは筋肉の主要成分であるアクチンとミオシンから構成されており、筋肉のように張力を発生します。細胞の形態維持や移動分裂など、細胞の動きを司っており、力を察知するセンサの役割もあると言われています。このため、SFに作用する力を調べることがメカノバイオロジーにおける重要なテーマとなります。このSFに作用する力を可視化するために用いられているのが「FRET型張力センサ」(図1下)です。FRET型張力センサはFRET効果(図2)を利用したもので、引張りによって蛍光の色が変化するタンパク質です。私たちはこれをアクチニンと呼ばれるSFを束ねるタンパク質の途中に挿入したものを開発しました(Actinin-sstFRET-GR)。そして、このタンパク質の遺伝子を電気パルスで培養細胞内に導入し、SFに作用する力を可視化してきました。しかし、この方法で導入されるセンサは10個の細胞中3個ほどにしか入らず、入ったとしても、1週間もしないうちに分解されてしまいます。また、組織内の細胞には全く入りません。このため、組織から細胞に至る幅広い対象を長時間観察することは不可能でした。
Clik here to view.
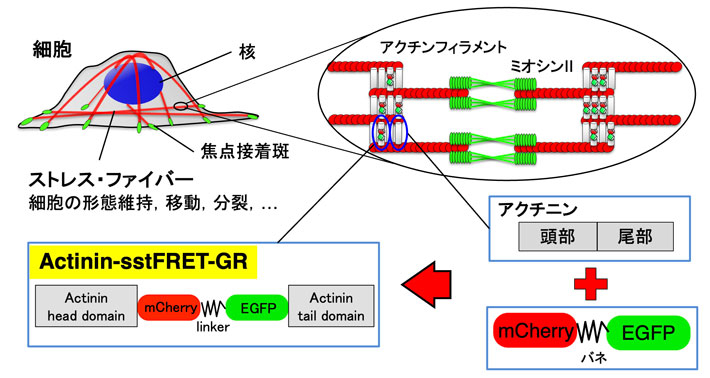
- 図1.
- 細胞の構造と、私たちの開発した張力センサ。細胞内部にはストレス・ファイバー(SF)と呼ばれる線維が走っている。SFは筋肉の主成分であるアクチンとミオシンからできており、収縮力を発生する。SF内でアクチンフィラメントを束ねているアクチニンの中央部にEGFPとmCherryという2つの蛍光タンパク質をバネのようなタンパク質で繋いだ張力センサを組み込んだ。SFに力が加わるとアクチニンが斜めになって引張られ、EGFPとmCherryの間隔も広がる。こうすると張力センサのFRET効率が低下する(蛍光色の赤が弱まり、緑が強まる)ために張力の変化が判る。
Clik here to view.
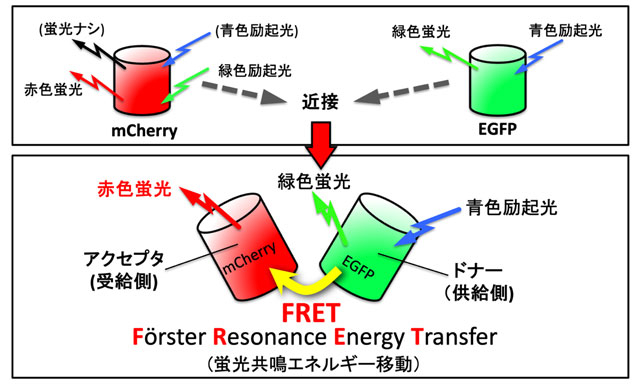
- 図2.
- FRETの原理。蛍光タンパク質EGFPは青色光を照射すると励起されて緑色蛍光を発する。一方、 mCherryは緑色光を照射すると赤色蛍光を発するが、青色光を照射しても何も起こらない。ところが、この2つの蛍光タンパク質を近づけると青色光により励起されたEGFPのエネルギーがmCherryに受け渡され、mCherryが赤色蛍光を発するようになる。従って、この緑色蛍光と赤色蛍光の強度比を測定すると両者の距離が判る。なお、エネルギーを与える側をドナー、受け取る側をアクセプタと呼ぶ。
細胞への遺伝子導入における問題点を解決するため、「FRET型張力センサ」の遺伝子をゲノムに組み込んだ遺伝子導入マウスが、2019年にカナダのグループによって開発されました。しかし、応答が十分でなく、FLIMという1億円近くするような高価な顕微鏡を用いないと観察できませんでした。そこで今回は、私たちが以前開発したActinin-sstFRET-GRを遺伝子導入したマウス(FRETマウス)の開発を進め、その作出に成功しました(図3)。そして、このマウスでは、一般に広く用いられている「共焦点顕微鏡」で張力変化を観察できる、即ち、組織を引張るとFRET比が低下することを、血管、腱、筋肉、あるいはそれらから単離した細胞で確認しました(図4)。また、それぞれの組織・細胞の張力に対する感度は血管壁では-0.68 (%FRET/%strain) であったのに対し、尾腱では-3.85、血管から単離した細胞では-1.54と、組織によって大きく異なる値を取ることを見出しました。そして、これらが組織や細胞の微細構造の差によるらしいこと、また、この違いが、それぞれの組織の機能の差で説明できることを示しました。
このマウスでは筋肉でも血管でも、SFを持つ細胞から構成される全ての組織、即ち、力と関係がある全ての組織が常にセンサを発現します。
Clik here to view.
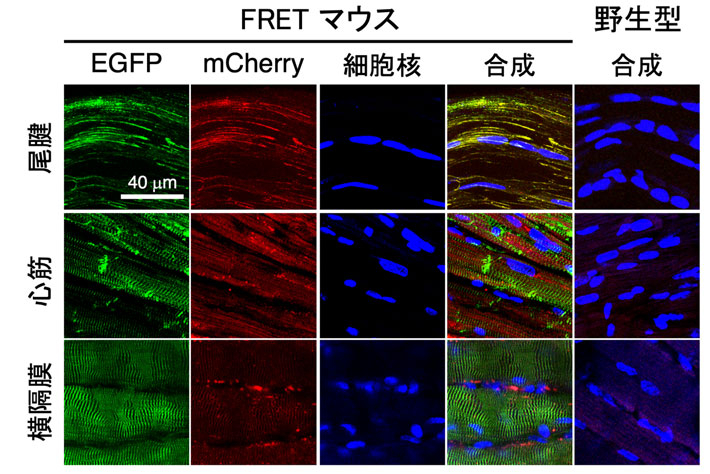
- 図3.
- センサの発現確認。FRETマウスの組織ではドナーEGFP、アクセプタmCherry、細胞核ともに光っており、合成画像でもそのことが判る。一方、野生型(通常マウス)では合成画像で見えるのは細胞核だけで、ドナーもアクセプタも観察されない。
Clik here to view.
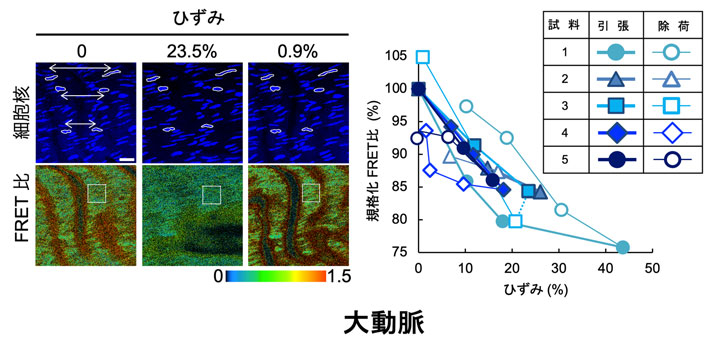
- 図4.
- 引張りに対する感度の確認。大動脈試料を周方向に引張った際の輪切断面のFRET比(赤色蛍光強度/緑色蛍光強度)の変化を左下のFRET比の白い四角で囲われた領域で計測した。右のグラフでは引張り前のFRET比を100%として規格化して表してある。ひずみは左上の白線で囲われた細胞核間距離の変化から算出した。5例の試料とも、引張るとFRET比が低下、除荷すると上昇し、その傾きは大体同じで-0.63 (%FRET/%strain) 程度であった。
成果の意義
本研究で開発したマウスを使うことで、様々な組織や細胞内の張力変化を知ることができると同時に、種々の発生段階、成長段階、あるいは老化の過程でこの応答がどう変化していくのか調べることもできるため、幅広いメカノバイオロジー分野において様々な応用が期待されます。
付記
本研究は、平成27年度から始まったAMED-CREST『革新的先端研究開発支援事業:メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出(JP19gm0810005)』、科学研究費補助金(21H04533、21K19902)ならびに中谷財団の支援のもとで行われたものです。
用語説明
[用語1] 蛍光 : 物質にある波長の光を照射(励起光と呼びます)したときに、同じ波長の光が出るのは「反射」や「散乱」ですが、照射光よりも長い波長の光が出るとき、この光を「蛍光」と呼びます。蛍光は励起光により原子核の周りを回る電子の軌道がエネルギー準位の高い軌道に変化し、その軌道が元に戻る時に発生します。この際、出てくるエネルギーは当然、入射エネルギーよりも小さくなります。光のエネルギーは波長に反比例しますので、励起光の波長に比べて長い波長の光が出ることになります。
[用語2] 蛍光タンパク質 : 蛍光を発するタンパク質のこと。名古屋大学で博士号を取得され2008年にノーベル化学賞を受賞された下村脩先生がオワンクラゲから1962年に精製し、報告した緑色蛍光タンパク(GFP)を嚆矢とし、それ以後、遺伝子組換技術などにより、赤色、黄色、青色などの蛍光タンパク質が続々と報告されています。例えば、調べたいタンパク質Aに蛍光タンパク質を組み込むことで、Aが蛍光で標識され、体内でのAの動きを知ることができるようになります。
[用語3] 共焦点顕微鏡 : 共焦点レーザー走査型顕微鏡(CLSM)とも呼ばれ、対象物に細く絞ったレーザー光を照射し、帰ってくる光をピンホールを通して受光することにより、ピントの合う深さ範囲を狭くした顕微鏡です。レーザー光を走査して画像を生成しますが、普通の顕微鏡と比べて高コントラストで、ピントの合う範囲が狭いことから、非常に薄い断層像を得ることができます。この断層像を重ねることで、細胞などの3次元構造を知ることができます。
[用語4] 力分布計測 : 生体組織は豆腐や羊羹のように一様な物体ではありません。コラーゲンやエラスチンといった丈夫な線維状タンパク質が絡み合い、その隙間に柔らかい細胞が挟まったような構造をしています。その線維の中にはピンと張っているものもあれば、弛んでいるものもあります。また、細胞は細胞膜で覆われた袋ですが、その内部はゲル状の細胞質で満たされた中に、やはりSFなどの細胞骨格と呼ばれる硬い線維性タンパク質が走っています。これらの線維の中には細胞核や細胞膜などを繋いでいるものもあれば、内側から細胞膜を押して、形を保っているものもあります。このため、生体組織に巨視的な変形を加えると、内部に引張力や圧縮力が発生しますが、その大きさは線維状タンパク質と細胞では大きく異なり、同じ繊維状タンパク質でも最初からピンと張っているものと弛んでいるものでは違います。また、細胞内部でも同様に細胞骨格の種類によって力分布は全く異なります。このように、組織や細胞は不均質で、しかも3次元的に複雑な構造をしているために、内部の力分布は計算機シミュレーションなどで簡単に求めることはできません。このため、巨視的に加えた力が組織・細胞内部で微視的にどのように分布しているのか、力分布を計測する必要があります。
[用語5] FILM : Fluorescence Lifetime Imaging Microscopy(蛍光寿命顕微法)のこと。蛍光寿命とは、蛍光を発する物質にパルス状に励起光を照射したときに、蛍光を発して基底状態に戻るまでの時間のことです。この蛍光寿命を観測し、試料を画像化する手法です。
論文情報
掲載誌 : |
Scientific Reports |
論文タイトル : |
In situ FRET measurement of cellular tension using conventional confocal laser microscopy in newly established reporter mice expressing actinin tension sensor |
著者 : |
Junfeng Wang, Eijiro Maeda, Yuki Tsujimura, Takaya Abe, Hiroshi Kiyonari, Tetsuya Kitaguchi, Hideo Yokota, Takeo Matsumoto |
DOI : |
- プレスリリース 引張り力で体中の蛍光色が変わるマウスの作出に成功 —組織から細胞まで内部張力の可視化を簡便に—
- 10^5個以上の菌株を数日で選別するタンパク質分泌生産株ハイスループットスクリーニング法を開発|東工大ニュース
- 赤色蛍光タンパク質型cGMPセンサーの開発と多色イメージングへの応用|東工大ニュース
- 異種のドーパミン受容体が結合したD1-D2ヘテロ多量体の活性化によってインスリン分泌が調節される|東工大ニュース
- 難治性疾患クッシング病の発症分子機構の一部を解明|東工大ニュース
- 赤色蛍光タンパク質型グルコースセンサーの開発|東工大ニュース
- 緑色蛍光タンパク質型乳酸センサーとピルビン酸センサーの開発|東工大ニュース
- 新規緑色蛍光タンパク質型グルコースセンサーを開発|東工大ニュース
- 生命活動の燃料「ATP」を観察する3色の蛍光センサーの開発に成功|東工大ニュース
- 北口哲也 Tetsuya Kitaguchi|研究者検索システム 東京工業大学STARサーチ
- 上田・北口研究室
- 科学技術創成研究院 化学生命科学研究所
- 科学技術創成研究院(IIR)
- 生命理工学院 生命理工学系
- 名古屋大学工学部・大学院工学研究科
- 理化学研究所 光量子工学研究センター
- 研究成果一覧
お問い合わせ先
東海国立大学機構 名古屋大学大学院工学研究科
教授 松本健郎
Email takeo@nagoya-u.jp
Tel 052-789-2721 / Fax 052-789-2695
東京工業大学 科学技術創成研究院 化学生命科学研究所
准教授 北口哲也
Email kitaguc.t.aa@m.titech.ac.jp
Tel 045-924-5270 / Fax 045-924-5248
理化学研究所 光量子工学研究センター
チームリーダー 横田秀夫
Email hyokota@riken.jp
Tel 048-462-1293 / Fax 048-462-1290
取材申し込み先
東海国立大学機構 名古屋大学広報課
Email nu_research@t.mail.nagoya-u.ac.jp
Tel 052-789-3058 / Fax 052-788-6272
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661
理化学研究所 広報室 報道担当
Email ex-press@ml.riken.jp
Tel 050-3495-0247