要点
- 200℃以下の低温で世界最高の酸化物イオン伝導度を示す新しい酸塩化物を創製・発見
- 結晶構造とイオン拡散経路の実験的な解析およびシミュレーションにより、高いイオン伝導度の要因を解明。イオン伝導体の新しい設計法を提案して実証。
- 低温で作動する高性能な燃料電池の開発につながると期待
概要
東京工業大学 理学院 化学系の矢口寛大学院生(研究当時)、八島正知教授らの研究グループは、200℃以下の低温域で従来の材料を超える酸化物イオン伝導度[用語1]を示す新材料の酸塩化物LaBi1.9Te0.1O4.05Cl(= Bi1.9Te0.1LaO4.05Cl)[用語2]を発見した。また、酸化物イオン伝導度が高い高温での結晶構造と酸化物イオン(O2−)の拡散経路を解明した。さらに、第一原理分子動力学シミュレーション[用語3]を行うことで、この新材料の酸化物イオン伝導メカニズムを明らかにした。その結果、酸化物イオンは格子間酸素席と格子酸素席[用語4]を介して二次元的に準格子間機構[用語5]により拡散するため、LaBi1.9Te0.1O4.05Clは高いイオン伝導度を示すことが分かった。また、この新しい酸化物イオン伝導体は、広い酸素分圧範囲で電気伝導度が一定で発電効率を落とす電子伝導を示さない上に、化学的に非常に安定であるという特徴も見出した。
本研究で実現した「準格子間機構によるBi含有高酸化物イオン伝導」は、従来のビスマス(Bi)を含む高イオン伝導体とは異なり、酸化物イオン伝導体の新しい設計指針となり、さまざまな新材料開発が期待される。また、低温域での高イオン伝導と高安定性の実現により、低温で作動する固体酸化物形燃料電池[用語6]など、高性能電気化学デバイスの開発につながると期待される。
本研究は、東北大学 多元物質科学研究所の森川大輔助教、同 学際科学フロンティア研究所の津田健治教授、高エネルギー加速器研究機構(KEK) 物質構造科学研究所/J-PARCセンターの齊藤高志特別准教授との共同研究である。
本研究成果は、2023年4月20日(現地時間)に国際学術誌「Advanced Functional Materials」電子版に掲載された。
背景
酸化物イオン伝導体は、酸化物イオン(O2−)伝導を示す物質であり、固体酸化物形燃料電池(SOFCs)、酸素分離膜、触媒およびガスセンサーなどに幅広く応用できる材料として期待されている。SOFCs で現在使用されているイットリア安定化ジルコニア(YSZ)電解質は、作動温度が高いため(700~1,000℃)製作コストが高く、高温での劣化のため長期にわたって使用できないという欠点が存在する。従って、低温(100~300℃)で高い伝導度を示す酸化物イオン伝導体を探索する必要がある。
これまでの研究において、一般的に酸化物イオンは固体の中で酸素空孔[用語7]を介して拡散するが(図1a)、近年、格子間席に存在する酸素が隣接する格子席にある酸素を押し出しながら拡散する準格子間機構に注目が集まっている(図1b)。またビスマス(Bi)を含む材料は高い酸化物イオン伝導度を示すことが知られている。すなわち、Bi を含み、かつ酸化物イオンが準格子間機構で拡散する材料は高い酸化物イオン伝導度を示すことが期待されるが、そのような材料は非常に稀である。

図1. (a)空孔機構および(b)準格子間機構による酸化物イオンの拡散機構 © Wiley、著者ら(2023)
研究成果
本研究では、新たなSillén酸塩化物[用語8]LaBi2−xTexO4+x/2Cl (= Bi2−xTexLaO4+x/2Cl; x = 0.1, 0.15, 0.2)を合成し、既知物質LaBi2O4Cl (= Bi2LaO4Cl; x = 0)も合成した。また、組成LaBi2−xTexO4+x/2Cl (x = 0, 0.1, 0.15, 0.2)の酸化物イオン伝導性と結晶構造を研究した。これらの化合物には、過剰酸素が入り込む空間(図1bの格子間席の空孔)が存在するので、準格子間機構による高酸化物イオン伝導が期待できる。
LaBi2−xTexO4+x/2Cl (x = 0, 0.1, 0.15, 0.2)の中では、x=0.1の組成LaBi1.9Te0.1O4.05Clのイオン伝導度が最も高いことが分かった。そこで、イオン伝導体LaBi1.9Te0.1O4.05Clにおける輸送特性を検討したところ、次の4つの結果が得られた。
- 1.
- 酸素濃淡電池[用語9]で測定したLaBi1.9Te0.1O4.05ClにおけるO2−の輸率[用語10]が1に近い。
- 2.
- LaBi1.9Te0.1O4.05Clの全電気伝導度は極めて広い酸素分圧(例えば400℃では酸素分圧が1.1×10−25~0.2気圧の領域)の領域で一定である。このことを高い化学的・電気的安定性を示すという。
- 3.
- 直流分極測定[用語11]において抵抗値が時間に依存しない。
- 4.
- プロトン(H+)の輸率が湿潤雰囲気でも無視できる。
1. ~ 4. の実験結果から、酸化物イオンが支配的なキャリア(電荷担体)であることが分かった。さらに第一原理分子動力学(AIMD: ab initio molecular dynamics)シミュレーションにおいて、酸化物イオンの平均二乗変位[用語12](MSD: mean-square displacement)が他の構成イオンのMSDよりも大きかったことからも、LaBi1.9Te0.1O4.05Clのキャリアが酸化物イオンであることが示唆された。
また、他の物質と酸化物イオン伝導度を比較したところ、図2に示すようにLaBi1.9Te0.1O4.05Clは96~201 ℃の温度範囲において最も高い酸化物イオン伝導度を示すこと、すなわち世界最高の酸化物イオン伝導度を示すことを見出した。例えばBi2V0.9Cu0.1O5.35に比べて121℃で5倍高いバルク伝導度をLaBi1.9Te0.1O4.05Clは示し、YSZに比べて300℃で320倍高いバルク伝導度を示す。一般的にBiを含む化合物は低い酸素分圧下で化合物中のBiイオンが還元されて分解してしまう可能性や電子伝導を示して伝導度が高くなる可能性がある。しかし、LaBi1.9Te0.1O4.05Clは 10−25 ~0.2気圧の広い酸素分圧範囲で分解せず、電気伝導度が酸素分圧に依存せずほぼ一定であるのでSOFCの効率を下げる電子伝導が無視でき、酸化物イオン伝導が支配的な優れた酸化物イオン伝導体であることが分かった。

図2. LaBi1.9Te0.1O4.05Clと既知の高酸化物イオン伝導体の酸化物イオン伝導度の比較 © Wiley、著者ら(2023)
次に、LaBi1.9Te0.1O4.05Clが高い酸化物イオン伝導度を示す要因を解明するため、25℃から400℃での温度範囲で中性子回折実験[用語13]を行い、リートベルト法[用語14]により結晶構造を解析した。LaBi1.9Te0.1O4.05Clは三重蛍石類似層[用語16]とCl 層が交互に積層した結晶構造を有しており、25℃から400℃の温度範囲ではLaBi1.9Te0.1O4.05ClはSillén相であることが分かった(図3)。三重蛍石類似層中の格子間 O2 席は準格子間機構による拡散を可能にするため、LaBi1.9Te0.1O4.05Clの高い酸化物イオン伝導性にとって三重蛍石類似層の存在が重要である。
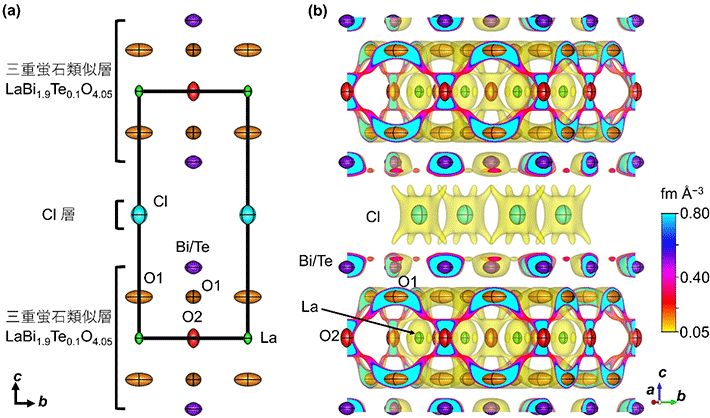
- 図3
- 400℃におけるLaBi1.9Te0.1O4.05Clの(a)結晶構造と(b)中性子散乱長密度分布とその等値面と結晶構造
© Wiley、著者ら(2023)
さらにイオン伝導経路を可視化するために、最大エントロピー法(MEM)[用語15a]により中性子散乱長密度分布[用語15b]を解析した。その結果、400℃で酸化物イオンは三重蛍石類似層中を2次元的に拡散することが示された(酸化物イオンの拡散経路:図3と図4の—O1—O2—O1—)。MEM解析により可視化された—O1—O2—O1—の拡散経路は、LaBi1.9Te0.1O4.05Clの酸化物イオンが準格子間機構により拡散する直接的な実験的証拠といえる。
![図4 LaBi1.9Te0.1O4.05Clの三重蛍石類似層のbc面(座標x=0.5)における(a)結晶構造と(b-d)中性子散乱長密度分布[(b)25℃、(c)200℃、(d)400℃]。(c、d)において酸化物イオンの拡散経路が可視化されている。 © Wiley、著者ら(2023)](http://www.titech.ac.jp//news/img/news-32358-04.png)
図4. LaBi1.9Te0.1O4.05Clの三重蛍石類似層のbc面(座標x=0.5)における(a)結晶構造と(b-d)中性子散乱長密度分布[(b)25℃、(c)200℃、(d)400℃]。(c、d)において酸化物イオンの拡散経路が可視化されている。 © Wiley、著者ら(2023)
最後に、AIMDシミュレーションにより酸化物イオンの拡散と局所的なダイナミクスを調べた。O2席の格子間酸化物イオンOB(図5ピンク色の球)は、隣接する空の格子間O2席に向かって最近接の格子O1席に存在する別の酸化物イオンOA(図5赤い球)を押し出しており、準格子間機構による拡散を明確に示している。

図5. AIMDによって計算した酸化物イオン拡散のスナップショット © Wiley、著者ら(2023)
以上の結果をまとめると、LaBi1.9Te0.1O4.05Clの極めて高い酸化物イオン伝導度および化学的・電気的安定性を示した。また、高い酸化物イオン伝導度の要因は酸化物イオンが三重蛍石類似層の格子間O2席と格子O1席を介して二次元的に準格子間機構で拡散するためであることを示した。
社会的インパクト
本研究では、世界最高の酸化物イオン伝導度と高い化学的・電気的安定性を併せ持つ新しい酸塩化物LaBi1.9Te0.1O4.05Clを創製・発見した。さらに新規高酸化物イオン伝導体の探索指針「三重蛍石類似層と準格子間機構によるBi含有高酸化物イオン伝導」も得ることができた。LaBi1.9Te0.1O4.05Clの創製・発見と、本研究で明らかにした探索指針によって、今後、酸化物イオン伝導性酸塩化物の研究開発が活発になると考えられる。また発見した新酸化物イオン伝導体は、低温で高性能なSOFC、酸素分離膜、触媒およびガスセンサーなどへの応用が見込まれている。こうした点から、本研究の成果には、エネルギー・環境問題を解決するという社会的インパクトがあるといえる。
今後の展開
本研究グループでは今後、創製・発見した新しい酸塩化物LaBi1.9Te0.1O4.05Clについて元素置換を行い、酸化物イオン伝導度と安定性を更に向上させることを検討している。また、LaBi1.9Te0.1O4.05Clを利用したSOFCを実用化するためには、燃料電池の作製と評価を行う必要がある。そのためには、LaBi1.9Te0.1O4.05Clに適した電極材料の開発を行うことが重要である。
付記
本研究の一部は、JSPS科学研究費助成事業基盤研究(A)「新構造型イオン伝導体の創製と構造物性」(19H00821)、JSPS科学研究費助成事業挑戦的研究(開拓)「本質的な酸素空孔層による新型プロトン・イオン伝導体の探索」(21K18182)、JST研究成果展開事業研究成果最適展開支援プログラム A-STEP 産学共同(JPMJTR22TC)、JSPS研究拠点形成事業(A.先端拠点形成型)「高速イオン輸送のための固体界面科学に関する国際連携拠点形成」および「エネルギー変換を目指した複合アニオン国際研究拠点」、JSPS科学研究費助成事業新学術領域研究(研究領域提案型)「複合アニオン化合物の理解:化学・構造・電子状態解析」等の助成を受けて行われた。
用語説明
[用語1] 酸化物イオン伝導度 : 外部電場を印加したとき酸化物イオン(O2−)が伝導する物質を酸化物イオン伝導体という。酸化物イオンが伝導することによる電気伝導度を酸化物イオン伝導度という。酸化物イオン伝導体を酸素イオン伝導体とも呼ぶ。酸化物イオン伝導体には純酸化物イオン伝導体や酸化物イオン-電子混合伝導体などがある。
[用語2] LaBi1.9Te0.1O4.05Cl : ランタン、ビスマス、テルル、酸素および塩素から構成される酸塩化物。本研究で初めて報告された新物質であり、Sillén酸塩化物の一つである。Bi1.9Te0.1LaO4.05Clと書くこともできる。
[用語3] 第一原理分子動力学シミュレーション : 実験データなど経験パラメータを用いずに、計算対象となる原子の種類と数と初期配置を用いて、量子力学に基づいて電子状態を計算することにより、原子間に働く力を見積もり、物質における原子の運動や物質の性質を調べるシミュレーション。
[用語4] 格子間酸素、格子間席 : イオン結晶では正規の格子位置に存在するイオンが充填しているが、充填した格子イオンの空隙位置(席)の一部にイオンが存在する物質がある。この空隙位置を格子間席と呼ぶ。格子間席に存在する酸素原子を格子間酸素と呼ぶ。
[用語5] 準格子間機構 : 格子席を経由せずに格子間席から格子間席に直接イオンが移動して拡散する機構を格子間機構と呼ぶ。一方、格子席のイオンが格子間席に移動するのと同時に、その格子間席に存在したイオンが別の格子席に移動する、2つのイオンの協力的な移動による拡散のメカニズムを準格子間機構と呼ぶ。ここで格子間機構ではイオンが格子席を介さずに移動するのに対し、準格子間機構では格子間席と格子席を介してイオンが移動する。
[用語6] 固体酸化物形燃料電池(SOFC; Solid Oxide Fuel Cell) : 電解質に固体を用いた燃料電池。電極、電解質を含め発電素子中に液体を使用せず、全て固体で構成される。高温で動作するため、白金などの高価な触媒が不要である。現在知られている燃料電池の形態では最も高い温度で稼働し、単独の発電装置としては最も発電効率が高い。SOFCの固体電解質には、酸化物イオン伝導体が用いられている。
[用語7] 酸素空孔 : 結晶において酸素原子が存在すべき位置で原子が存在しないところを酸素空孔と呼ぶ。
[用語8] Sillén酸塩化物 : [M2O2]や[M3O4+n]などの蛍石型構造に類似した構造を有する蛍石類似層と、Cl層または陽イオンMを含むCl層が積層した結晶構造を持つ酸塩化物をいう。
[用語9] 酸素濃淡電池 : 陽極と陰極の種類が同じ酸素であり、その酸素分圧が異なる電池。
[用語10] 輸率 : 酸素輸率は、全電気伝導度σtotと酸化物イオン伝導度σO2-の比、σO2-/σtotにより定義される。酸素濃淡電池の起電力を用いて、電解質の酸素輸率を見積もることができる。酸素輸率が1に近いと、酸化物イオンが支配的なキャリアであることを示している。SOFCでは電子伝導があると発電効率が低下するので、酸素輸率が1に近いことが好ましい。
[用語11] 直流分極測定 : 一定の電圧をサンプルに印加したときの電流の時間変化を測定すること。または一定の電流をサンプルに流したときの電圧の時間変化を測定すること。本研究では一定の電圧をサンプルに印加したときの電流値が時間に依存しなかったので、外部から供給されない陽イオンや塩化物イオン伝導ではなく、外部から供給できる酸化物イオン伝導であると考えられる。
[用語12] 平均二乗変位 : 分子動力学計算における平均二乗変位とは、原子の変位量(位置の変化量、すなわち位置の差)の二乗の平均値である。平均二乗変位の平方根が原子の移動量の目安になる。
[用語13] 中性子回折実験 : 数~数十Åの周期で原子が規則的に配列する結晶は、X線や中性子によって回折現象を起こす。得られる回折データは、結晶構造の情報を含んでおり、解析することで結晶内の原子配列などを明らかにすることができる。X線は電子により散乱されるので、重元素のコントラストが高い。一方、中性子では重元素と酸素などの軽元素の両方を含む物質における軽元素のコントラストが相対的に高いので、軽元素の原子の原子座標、占有率と原子変位パラメータを正確に決めることができる。
[用語14] リートベルト法 : 粉末回折データを用いて、結晶学パラメータ(格子定数、原子座標、占有率、原子変位パラメータ等)を求める手法。
[用語15a] 最大エントロピー法(Maximum-Entropy Method; MEM) : MEMは情報理論の一つで、計測データの不確かさ(情報エントロピー)が統計的に尤もらしく(最大に)なるように推定する方法である。MEMを使うと、信号のノイズを低減させ、より鮮明な信号にすることが出来る。中性子散乱長密度分布とは原子核の密度分布に中性子の原子散乱能(中性子散乱長)を掛けたものである。リートベルト解析により得られた構造因子に対してMEMを適用すると、より正確な中性子散乱長密度分布が得られる。
[用語15b] 中性子散乱長密度分布 : [用語15a]を参照。
[用語16] 三重蛍石類似層 : 層状化合物の結晶構造に含まれる、3つの陽イオンM層を含む蛍石類似層(蛍石型化合物に原子配列が類似した層)。図3aに示すようにLaBi1.9Te0.1O4.05Clにおける三重蛍石類似層は3つの陽イオン層、Bi/Te層、La層、Bi/Te層を持つ。
論文情報
掲載誌 : |
Advanced Functional Materials Vol.33, 2214082 (2023) |
論文タイトル : |
High Oxide-ion Conductivity through the Interstitial Oxygen Site in Sillén Oxychlorides(Sillén酸塩化物の格子間酸素席を介した高い酸化物イオン伝導度) |
著者 : |
Hiroshi Yaguchi, Daisuke Morikawa, Takashi Saito, Kenji Tsuda, Masatomo Yashima* (* 責任著者) |
DOI : |
- プレスリリース 世界最高の酸化物イオン伝導度を示す新酸塩化物を創製・発見し、高い酸化物イオン伝導度のメカニズムを解明 —低温で高性能な燃料電池の発展に向けた材料開発を加速—
- 無機化合物の2つの基本構造の共存と制御を達成|東工大ニュース
- 高伝導度・安定性を併せ持つ新型酸化物イオン伝導体を発見|東工大ニュース
- 希土類を含まない世界最高クラスの酸素イオン伝導体を発見|東工大ニュース
- ソフトな陰イオンをもつ逆ペロブスカイト化合物で高速イオン伝導を達成|東工大ニュース
- 最高水準の伝導度を示す新型プロトン伝導体を発見|東工大ニュース
- 世界最高クラスの新型電解質材料を発見|東工大ニュース
- アパタイト型酸化物イオン伝導体における高イオン伝導度の要因を解明|東工大ニュース
- 新型の酸化物イオン伝導体である新物質SrYbInO4を発見 —燃料電池や酸素分離膜等の開発を加速—|東工大ニュース
- 新しい構造をもつ酸化物イオン伝導体NdBaInO4の発見 —固体酸化物形燃料電池の高能率・低コスト化に道—|東工大ニュース
- 新構造の酸化物イオン伝導体を発見 中性子と放射光で構造決定・イオンの流れを可視化|東工大ニュース
- 八島研究室
- 八島正知 Masatomo Yashima|研究者検索システム 東京工業大学STARサーチ
- 理学院 化学系
- 東北大学 多元物質科学研究所
- 学際科学フロンティア研究所
- 高エネルギー加速器研究機構(KEK)
- 物質構造科学研究所
- 研究成果一覧
お問い合わせ先
東京工業大学 理学院 化学系
教授 八島正知
Email yashima@cms.titech.ac.jp
Tel 03-5734-2225 / Fax 03-5734-2225
取材申し込み先
東京工業大学 総務部 広報課
Email media@jim.titech.ac.jp
Tel 03-5734-2975 / Fax 03-5734-3661

