要点
- ビフィズス菌は、乳児期の腸内フローラにおいて優勢になることが知られていたがメカニズムが分かっていなかった。
- 本研究では、生後1か月の間に乳児の腸内フローラが大きく変化し、腸内細菌科およびスタフィロコッカス科に属する細菌群が優勢のフローラ構成から、ビフィズス菌が優勢のフローラ構成に変動することを明らかにした。
- ビフィズス菌が優勢になるためには、母乳に含まれるオリゴ糖の主要構成成分「フコシルラクトース」が重要な役割を果たしていることをゲノム解析により解明した。
概要
東京工業大学 生命理工学院 生命理工学系の森宙史助教、山本和也大学院生※、山田拓司准教授、黒川顕特任教授(兼国立遺伝学研究所教授)はヤクルト本社中央研究所の松木隆広博士、帝京大学医学部の児玉浩子博士らの研究グループと共同で、乳児期のビフィズス菌優勢の腸内フローラ[用語1]形成には、母乳オリゴ糖の主要な構成成分であるフコシルラクトース(FL)[用語2]が重要であることを突き止めた。
FLを利用できるビフィズス菌が定着した乳児は、そうでない乳児に比べて便中のビフィズス菌の占有率や酢酸濃度が高く、大腸菌群の占有率やpHが低いことがわかった。ビフィズス菌に利用されるFLを輸送するABC輸送体[用語3]がビフィズス菌優勢の腸内フローラの形成において中心的な役割を担っていることを解明した。これはビフィズス菌のオリゴ糖利用性が、乳児とビフィズス菌の共生関係の構築に重要であることを示し、乳幼児期におけるビフィズス菌優勢の腸内フローラの意義の解明につながることが期待される。
研究成果は6月24日発行の英科学誌「ネイチャーコミュニケーションズ(Nature Communications)」に掲載された。
- ※
- は研究当時の肩書
![乳児腸内フローラ形成とビフィズス菌によるフコシルラクトース(FL)利用の分子機構]()
概念図 乳児腸内フローラ形成とビフィズス菌によるフコシルラクトース(FL)利用の分子機構
(a)生後1か月間の乳児腸内フローラの形成過程には次のような特徴がある。乳児の腸内フローラはStaphylococcaceae、大腸菌群、ビフィズス菌のいずれかが最優勢であることを特徴とする3つのグループに分類される、ビフィズス菌優勢のフローラに不可逆的に移行する、その移行時期には個人差が認められる。
(b)ビフィズス菌には母乳オリゴ糖を効率よく利用できる菌とできない菌が存在する。母乳オリゴ糖の主成分であるFLの利用には、今回見出したFL輸送体が重要な役割を果たしている。このFL輸送体は、乳児の腸内の酢酸濃度とpHを規定する重要な遺伝子である。
研究の背景
最近の研究により、乳児期の腸内フローラ構成が成長後の個体の生理機能に大きな影響を及ぼすことが明らかとなっている。また、これまでの多くの研究から、乳児ではビフィズス菌優勢の腸内フローラが形成されることは明らかになっているが、乳児期の腸内フローラ形成の法則性やビフィズス菌優勢の腸内フローラの形成機構は十分に明らかとはなっていなかった。
そこで、乳児から生後1か月間に提供された糞便サンプルのフローラ構成を調べ、その動的変化と平衡、ならびに代謝産物との関係性を調べることにより、ビフィズス菌優勢の腸内フローラの形成に影響を及ぼす環境要因とビフィズス菌の特性について解析をした。
研究成果
(1)乳児期の腸内フローラ構成
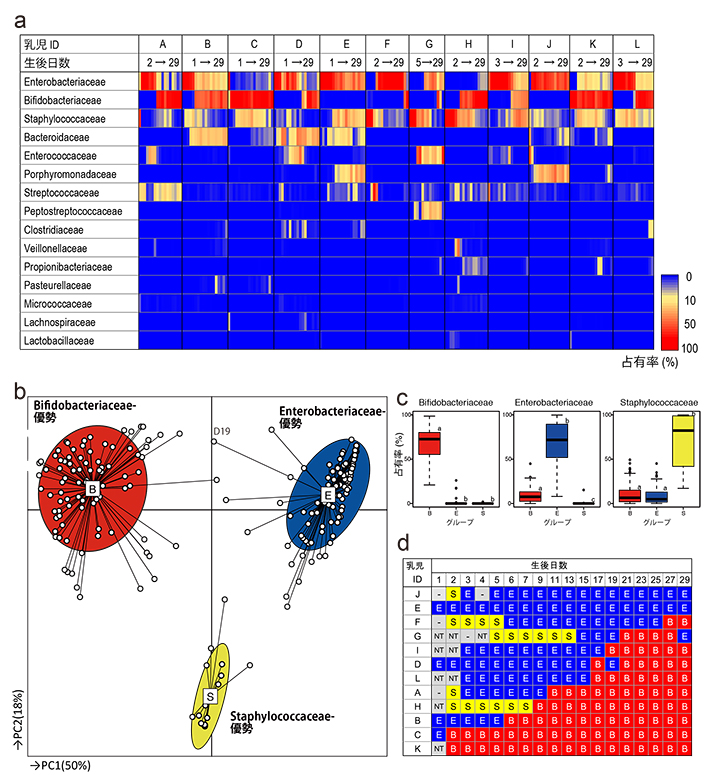
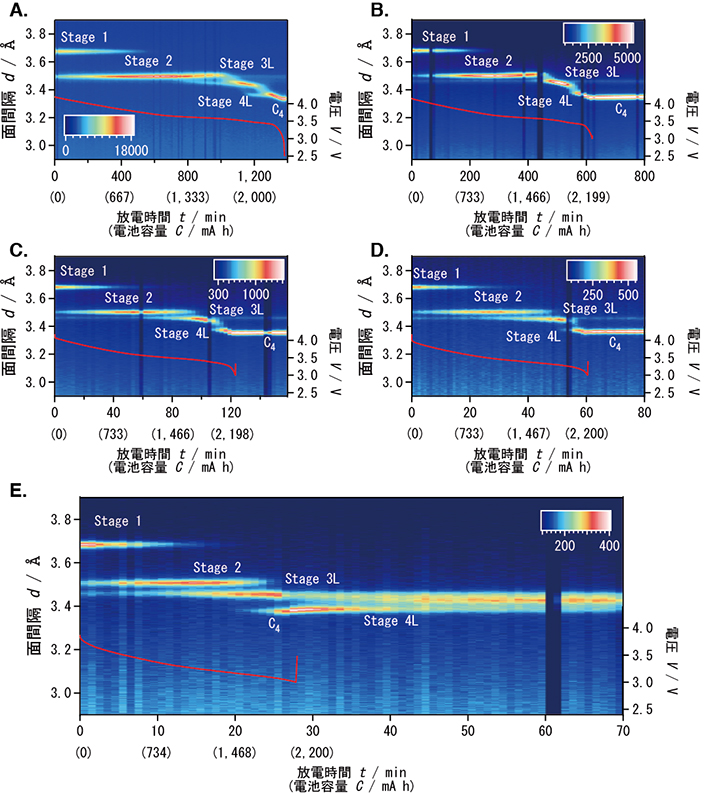
通常分娩で生まれた12名の母乳により保育される新生児より、生後1か月間糞便を採集し、乳児期の腸内フローラ形成過程を解析した(図1-a)。その結果、生後1か月間の腸内フローラは、Bifidobacteriaceae(ビフィドバクテリア科)、Enterobacteriaceae(腸内細菌科)、またはStaphylococcaceae(スタフィロッカス科)が優勢の3つのグループに分類できることが、主成分分析およびクラスター分析によって明らかになった(図1-b、c)。さらに興味深いことに、各グループ間の変遷には法則性があり、Staphylococcaceaeが優勢のグループからEnterobacteriaceaeが優勢のグループへ、Enterobacteriaceaeが優勢のグループからBifidobacteriaceaeが優勢のグループへ不可逆的に変化することが分かった(図1-d)。
![生後1か月間の乳児腸内フローラ構成の変化]()
図1. 生後1か月間の乳児腸内フローラ構成の変化
(a)ヒートマップ解析結果:各被験者の生後1か月間の腸内フローラ構成を、時間経過に沿って左から右にカラースケールで示した。
(b)多変量&クラスター解析結果:白丸は被験者サンプル、四角は各グループの中心を示す。ビフィズス菌優勢、大腸菌群優勢、Staphylococcaceaeが優勢のフローラを、それぞれB(赤)、E(青)、S(黄)で示した。色づけされた楕円には各グループに属するサンプルの67%が含まれる。
(c)各クラスターを特徴付ける菌群の占有率をボックスプロットにて比較した。ボックス右上の異なるアルファベット(a-c)は、群間で占有率が有意に異なることを示す(p<0.05、マンホイットニーU検定)。
(d)生後の日数経過と優勢菌群の遷移。
(2)生後1か月目の腸内フローラ構成
上述の12名の新生児に加え、通常分娩で生まれた15名の母乳により保育される新生児より糞便の採集を行い(計27名)、生後1か月目の腸内フローラ構成を調べた。さらに、これら新生児の保護者(成人)22名より糞便の採集を行い、腸内フローラ構成を調べた。
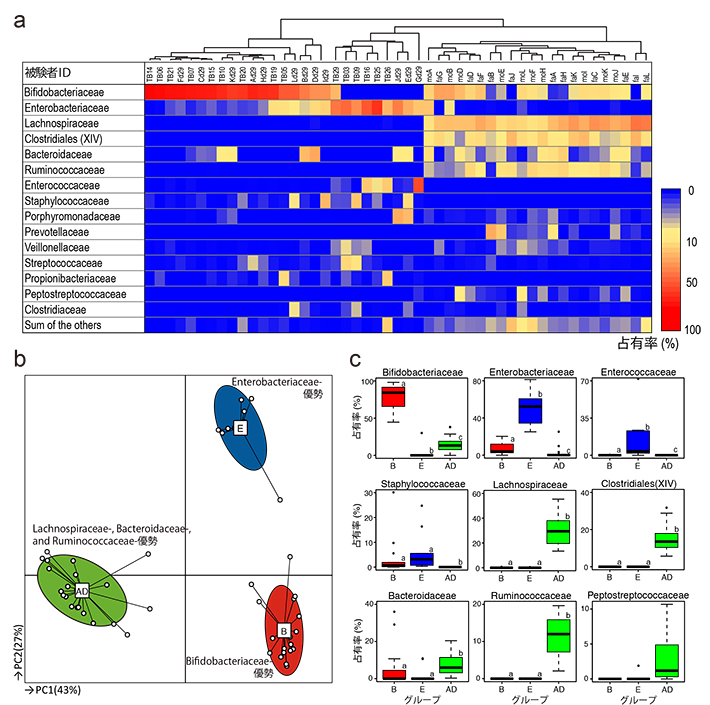
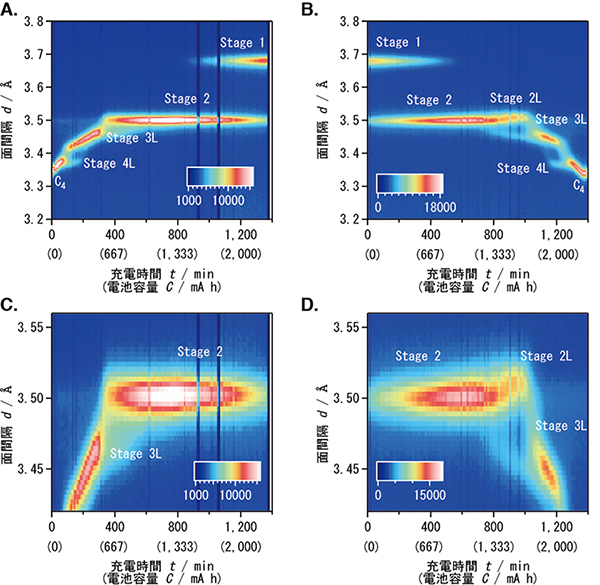
その結果、生後1か月目の腸内フローラ構成は、Bifidobacteriaceaeが優勢のグループとEnterobacteriaceaeが優勢の2つのグループに分類できた。一方、成人の腸内フローラ構成は、Lachnospiraceae(ラクノスピラ科)、Clostridiales incertae sedis X I V、Bacteroidaceae(バクテロイデス科)、Ruminococcaceae(ルミノコッカス科)およびPeptostreptococcaceae(ペプトストレプトコッカス科)優勢のグループのみだった(図2-a、b、c)。
![1か月目の乳児(27名)と成人(22名)の腸内フローラ構成の比較]()
図2. 1か月目の乳児(27名)と成人(22名)の腸内フローラ構成の比較
(a)ヒートマップ解析結果:腸内フローラ構成に基づく階層的クラスタリングを行い、作成した樹形図を元にサンプルを並べ替えた(図上部)
(b)多変量解析結果(PCoA&PAM):ビフィズス菌優勢、大腸菌群優勢、成人型フローラを、それぞれB(赤)、E(青)、AD(黄緑)で示した。
(c)各クラスターを特徴付ける菌群の占有率をボックスプロットにて比較した。ボックス右上の異なるアルファベット(a-c)は、群間で占有率が有意に異なることを示す(p<0.05、マンホイットニーU検定)。
(3)腸内フローラ構成と腸内環境
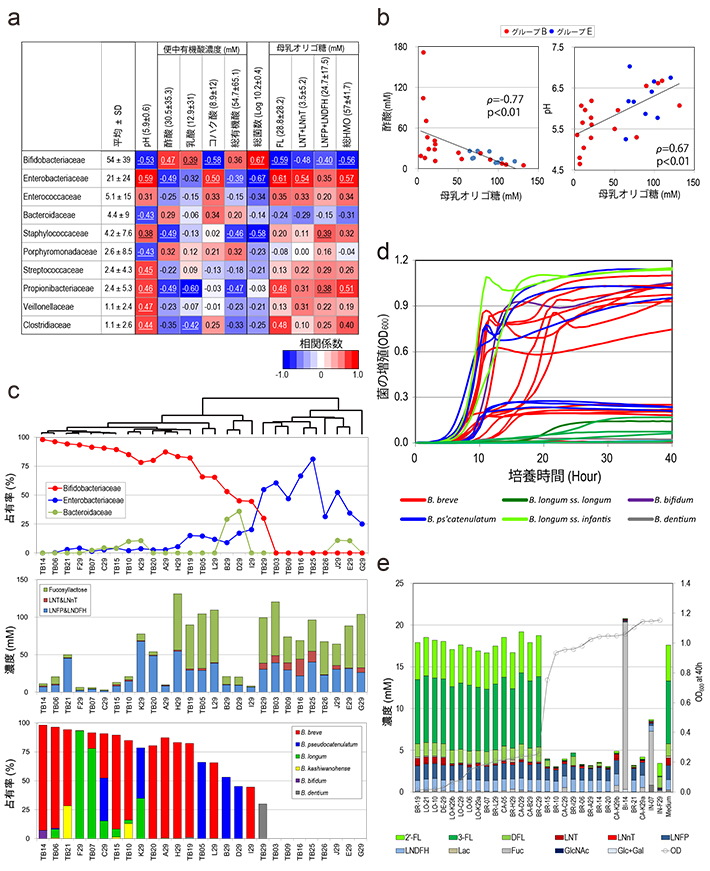
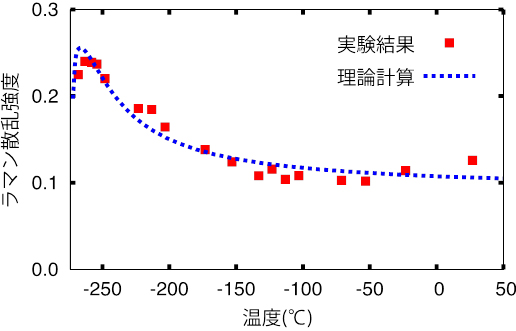
腸内細菌の定着が腸内環境に及ぼす影響を調べるために、乳児糞便中のpHならびに有機酸の測定を行い、腸内フローラ構成との関係を調べたところ、Bifidobacteriaceaeの占有率は、糞便の有機酸濃度と正に相関すること、ならびに糞便pHと負に相関することが分かった(図3-a)。これまでの研究で、ビフィズス菌は母乳オリゴ糖(Human Milk Oligosaccharide、HMO)を利用することにより、その代謝産物として酢酸や乳酸を産生することが報告されていることから、乳児糞便中の残存HMO量の測定を行った。
その結果、糞便中のHMOの減少と糞便Bifidobacteriaceae占有率の増加、有機酸濃度の増加、pHの低下との間には相関関係が見られた(図3-b)。しかし、一部の乳児では、Bifidobacteriaceaeが存在するにも関わらず、糞便中に高濃度のHMOが残存していることが明らかになった(図3-c)。
そこで、ビフィズス菌のHMOの利用能を調べるために、糞便よりビフィズス菌29株を分離し、HMOを唯一の炭素源とする培地を用いてビフィズス菌の増殖性、ならびにHMOの利用性を調べた。その結果、図3-d、eに示したとおり、29株中14株はHMO添加培地で生育したが、15株は生育できなかった。
培地中の残存オリゴ糖を調べた結果、ほとんどのビフィズス菌株はHMOの構成成分のひとつであるラクト-N-テトラオースを利用していたが、HMOの主要な構成成分であるFLの利用性は単離したビフィズス菌株により顕著な差があった。これらのことから、乳児糞便中のビフィズス菌によるFL利用性は菌株特異的であることが分かった。
![腸内フローラ構成と腸内環境の関連性]()
図3. 腸内フローラ構成と腸内環境の関連性
(a)スピアマンの順位相関係数:腸内フローラ構成菌と腸内環境を比較した。
(b)便中残存オリゴ糖濃度とpH値および酢酸濃度の関連性。
(c)腸内フローラ構成と便中のオリゴ糖濃度、およびビフィズス菌種の占有率との関係。腸内フローラ構成に基づく階層的クラスタリングを行い、作成した樹形図を元にサンプルを並べ替えた(図上部)。
(d)乳児から分離した29株のビフィズス菌を母乳オリゴ糖を唯一の糖源として培養した時の増幅曲線。
(e)培養上清の残存オリゴ糖解析結果、顕著な増殖が認められた株では、母乳オリゴ糖の主成分のFLがほとんど消費されている。
(4)ビフィズス菌のゲノムとFL利用性
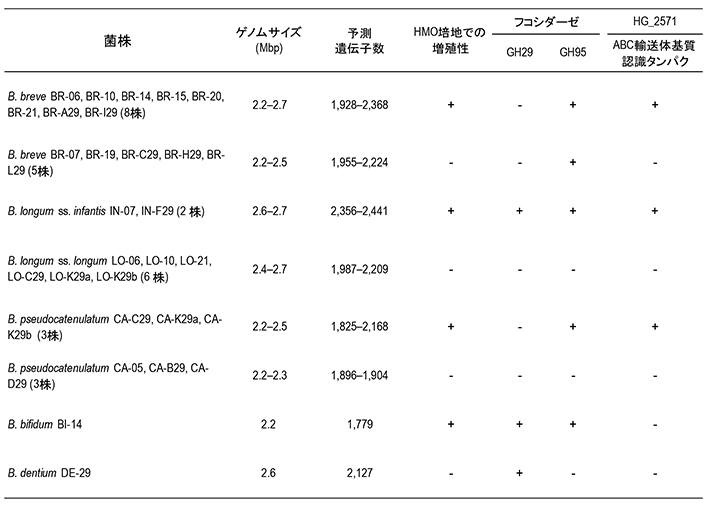
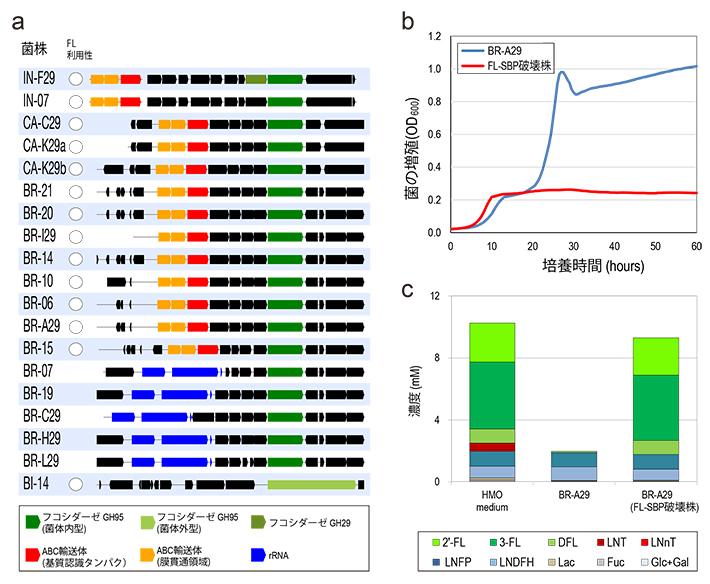
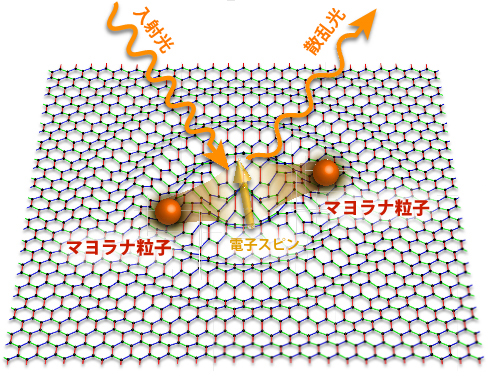
乳児のビフィズス菌によるFL利用機構を明らかにするために、ビフィズス菌29株のゲノム解析を行った(表1)。各菌株がもつ遺伝子を詳細に解析したところ、新たに見いだされたABC輸送体がFLを利用できる菌株にのみ存在していた(図4-a)。
さらに、このABC輸送体遺伝子がFL利用性に関わっているのかを明らかにするために、このABC輸送体を欠損させたビフィズス菌株を作製し、HMOを含んだ培地での増殖性とFLの消費を調べたところ、ABC輸送体欠損ビフィズス菌では増殖が抑制され、FLも利用されていないことが確認された(図4-b、c)。このことから、今回新たに見いだされたABC輸送体がHMOの主要構成成分であるFL利用の中心的な働きを担っていることが分かった。
表1. ビフィズス菌29株のドラフトゲノム解析結果の概要
![ビフィズス菌29株のドラフトゲノム解析結果の概要]()
![母乳オリゴ糖の利用に関わる遺伝子の同定]()
図4. 母乳オリゴ糖の利用に関わる遺伝子の同定
(a)フコシダーゼ遺伝子(GH95およびGH29ファミリー遺伝子)の近傍の遺伝子配置。矢印は遺伝子がコードされている方向性を示す。
(b)フコシダーゼ近傍のABC輸送体(FL-SBP)の遺伝子破壊株。
(c)培養上清の残存オリゴ糖解析結果。破壊株では、FLが利用できなくなっていることが確認された。
(5)FL利用能を有するビフィズス菌による腸内環境への作用
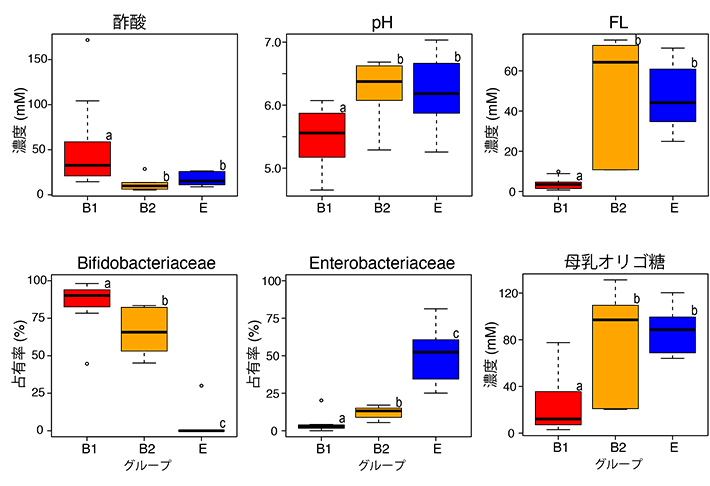
27名の乳児を、FL輸送用のABC輸送体を保有するビフィズス菌株が優勢な乳児、FL非利用なビフィズス菌株が優勢な乳児、ならびにEnterobacteriaceaeが優勢な乳児に群分けし、糞便有機酸、pH、残存HMO量、腸内フローラの比較を行った(図5)。その結果、FL利用能を保有するビフィズス菌株が優勢な乳児の糞便では、他の群の乳児に比べ、糞便中のBifidobacteriaceae占有率が高く、Enterobacteriaceae占有率が低いことが明らかになった。また、FL利用能を保有するビフィズス菌株が定着した乳児の糞便では、残存のFL濃度が低く、並びに酢酸濃度が高くpHが低い値を示した。
![FL利用ビフィズス菌の定着による腸内微生物生態系への影響]()
図5. FL利用ビフィズス菌の定着による腸内微生物生態系への影響
FL利用ビフィズス菌が優勢の乳児(B1グループ)、FL非利用ビフィズス菌が優勢の乳児(B2グループ)、大腸菌群が優勢の乳児(Eグループ)の比較をボックスプロットで表した。ボックス右上の異なるアルファベット(a-c)は、群間で占有率が有意に異なることを示す(p<0.05、マンホイットニーU検定)。
今後の展開
前述したように、乳児期の腸内フローラ構成が成長後の個体の生理機能に大きな影響を及ぼすことが報告されている。これまでの研究から、多くの乳児の腸管内では、ビフィズス菌が最優勢菌となる腸内フローラが形成されることが明らかになっている。しかし、ビフィズス菌優勢の腸内フローラ形成の法則性やその形成機構は十分に明らかとはなっていなかった。
今回の研究により、乳児期の腸内フローラは、Staphylococcaceae、Enterobacteriaceae、Bifidobacteriaceaeのいずれかが最優勢なフローラが形成されていること、ビフィズス菌優勢の腸内フローラ構成に不可逆的に変化すること、その移行時期は乳児によって異なることが明らかになった。また、ビフィズス菌のHMO利用性が、糞便中のビフィズス菌の占有率と酢酸および残存オリゴ糖濃度、pH、大腸菌群占有率に大きな影響を及ぼしていることも明らかになった。
さらにHMOの主要な構成成分であるFLの利用にあたり、新たに見いだされたABC輸送体が重要な役割を果たしていることが分かった。新たに同定されたABC輸送体を保有するビフィズス菌株が定着した乳児では、FL利用性ビフィズス菌のHMO代謝により、腸内のビフィズス菌占有率が上昇する結果、酢酸など有機酸生成が高まり、腸管内のpHが低下したと考えられる。
これらの腸内環境の変化がEnterobacteriaceae占有率に影響を及ぼしていることが予想される。すなわち、今回の研究で見いだされたビフィズス菌が保有するABC輸送体は、乳児とビフィズス菌の共生関係構築のために重要な因子であることが示された。
用語説明
[用語1] 腸内フローラ : 様々な生物の腸内には、多種多様な微生物が群集を形成して棲息しており、この腸内微生物群集のことを、腸内フローラ(flora)とも呼ぶ。成人のヒト腸内の場合、数百種以上の種からなる数十兆個以上の細胞が集まり、群集を形成していると見積もられている。
[用語2] フコシルラクトース : 分子式C18H32O15で表される、ヒトの母乳に最も多く含まれているオリゴ糖の一種。
[用語3] ABC輸送体 : 複数のタンパク質が集まって構成される構造体であり、細胞膜等の生体膜に存在し、生体膜の内と外とで特定の基質の輸送をATPを消費して行う。
論文情報
論文タイトル : |
A key genetic factor for fucosyllactose utilization affects infant gut microbiota development |
著者 : |
Takahiro Matsuki, Kana Yahagi, Hiroshi Mori, Hoshitaka Matsumoto, Taeko Hara, Saya Tajima, Eishin Ogawa, Hiroko Kodama, Kazuya Yamamoto, Takuji Yamada, Satoshi Matsumoto, & Ken Kurokawa |
掲載誌 : |
Nature Communications |
DOI : |
|